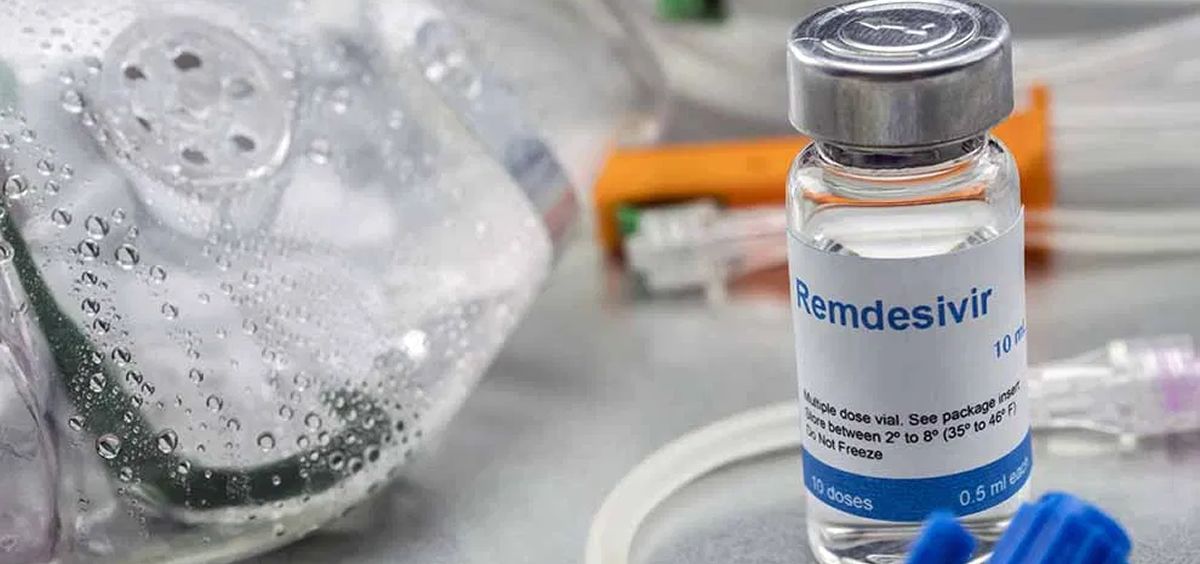
Gilead Sciences ha anunciado que la Agencia del Medicamento de Estados Unidos (FDA por sus siglas en inglés) ha aprobado el medicamento antiviral Veklury (remdesivir) para el tratamiento de pacientes con coronavirus que requieren hospitalización.
Según ha informado la compañía en un comunicado, como fármaco antiviral, Veklury actúa para detener la replicación del SARS-CoV-2, el virus que causa Covid. Anteriormente autorizado por la FDA para uso de emergencia para tratar la enfermedad, Veklury es ahora el primer y único tratamiento Covid-19 aprobado en los Estados Unidos. El medicamento ahora está ampliamente disponible en hospitales de todo el país, tras inversiones iniciales para expandir rápidamente la capacidad de fabricación para aumentar la oferta.
En Estados Unidos, Veklury está indicado para pacientes adultos y pediátricos (a partir de los 12 años y que pesen al menos 40 kilogramos) para el tratamiento de Covid-19 que requiera hospitalización.
Veklury solo debe administrarse en un hospital o en un entorno de atención médica capaz de brindar atención aguda comparable a la atención hospitalaria para pacientes hospitalizados. Veklury está contraindicado en pacientes alérgicos a Veklury o cualquiera de sus componentes.
Esta aprobación se basa en tres ensayos controlados aleatorios que incluyen los resultados finales publicados recientemente del ensayo de Fase 3 ACTT-1, doble ciego y controlado con placebo del Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID por sus siglas en inglés), que mostró que el tratamiento con Veklury dio como resultado mejoras clínicamente significativas en múltiples evaluaciones de resultados en comparación con placebo en pacientes hospitalizados con Covid-19. Basado en la solidez de estos datos, Veklury se ha convertido en un estándar de atención para el tratamiento de coronavirus en pacientes hospitalizados.
Veklury es el primer y único tratamiento aprobado por la FDA para coronavirus en Estados Unidos
"La aprobación de Veklury marca un hito importante en los esfuerzos para ayudar a abordar la pandemia al ofrecer un tratamiento eficaz que ayuda a los pacientes a recuperarse más rápido y, a su vez, ayuda a preservar los escasos recursos de atención médica", ha señalado Barry Zingman, profesor de medicina en Albert Einstein College of Medicine y Montefiore Medical Center de Nueva York.
“La disponibilidad de un tratamiento rigurosamente probado que puede acelerar significativamente la recuperación y ofrece otros beneficios como tasas más bajas de progresión a la ventilación mecánica, brinda a los pacientes hospitalizados y sus familias una esperanza importante y ofrece a los proveedores de atención médica una herramienta fundamental para atender a los pacientes que lo necesitan", ha añadido Zingman.
“Desde el comienzo de la pandemia de COVID-19, Gilead ha trabajado sin descanso para ayudar a encontrar soluciones a esta crisis de salud global. Es increíble estar hoy en la posición, menos de un año desde los primeros informes de casos de la enfermedad ahora conocida como Covid-19, de tener un tratamiento aprobado por la FDA en los EE. UU. Que esté disponible para todos los pacientes apropiados que lo necesiten", ha detallado, por su parte, Daniel O'Day, presidente y director ejecutivo de Gilead Sciences, al tiempo que ha subrayado que “la velocidad y el rigor con que se ha desarrollado y aprobado Veklury en Estados Unidos reflejan el compromiso compartido de Gilead, las agencias gubernamentales y los investigadores de ensayos clínicos para avanzar en opciones de tratamiento eficaces y bien toleradas para la lucha contra el Covid-19".
ENSAYO ACTT-1
En el ensayo ACTT-1 aleatorizado, doble ciego y controlado con placebo, Veklury mejoró significativamente el tiempo de recuperación en comparación con el placebo, en cinco días en la población general del estudio (10 frente a 15 días; índice de tasas, 1,29; IC del 95% , 1,12 a 1,49; p <0,001) y siete días en pacientes que requirieron soporte de oxígeno al inicio (11 vs.18 días; razón de tasas, 1,31; IC del 95%, 1,12 a 1,52). Como criterio de valoración secundario, Veklury también redujo la progresión de la enfermedad en pacientes que necesitaban oxígeno, lo que resultó en una incidencia significativamente menor de nueva ventilación mecánica o ECMO (13% frente a 23%; IC del 95%, -15 a -4). En la población general de pacientes, hubo una tendencia hacia una reducción de la mortalidad con Veklury en comparación con placebo el día 29 (11,4% frente a 15,2%, HR 0,73; IC del 95%, 0,52 a 1,03). Los datos de mortalidad adicionales de un análisis post-hoc se publicaron en la Revista de Medicina de Nueva Inglaterra el 8 de octubre de 2020.
Los resultados del ensayo ACTT-1 se complementan con los resultados de dos ensayos abiertos de fase 3 de Veklury realizados en pacientes adultos con COVID-19 grave y moderado. El ensayo SIMPLE-Severe, realizado en pacientes hospitalizados que requerían oxígeno suplementario y que no estaban ventilados mecánicamente, encontró que un ciclo de tratamiento de cinco o diez días de Veklury logró resultados clínicos similares (razón de posibilidades 0,75; IC del 95%, 0,51 a 1.12). El ensayo SIMPLE-Moderate, realizado en pacientes hospitalizados que no requerían oxígeno suplementario, mostró resultados clínicos estadísticamente mejorados con un ciclo de tratamiento de cinco días de Veklury en comparación con el estándar de atención (odds ratio 1,65; IC del 95%, 1,09 a 2,48; p = 0,017). Las probabilidades de mejora en el estado clínico con el curso de tratamiento de 10 días de Veklury frente al tratamiento estándar también fueron favorables.
La incidencia de eventos adversos asociados con Veklury fue similar a la del placebo en el ensayo ACTT-1. Las tasas de eventos adversos graves (AAG) fueron numéricamente más altas en el grupo de placebo en comparación con el grupo de Veklury. La interrupción del tratamiento, los eventos adversos (EA) por todas las causas de grado 3 y 4 y las anomalías de laboratorio fueron similares en todos los grupos. En el ensayo SIMPLE-Severe, las reacciones adversas más comunes que ocurrieron en al menos el 5% de los sujetos en el grupo de Veklury de 5 días o de 10 días, respectivamente, fueron náuseas (5% frente a 3%), aumento de AST (3% vs 6%) y ALT aumentó (2% vs 7%). En el ensayo SIMPLE-Moderate, la reacción adversa más común que ocurrió en al menos el 5% de los sujetos en los grupos de Veklury fueron náuseas (7% en el grupo de 5 días, 4% en el grupo de 10 días).
Paralelamente a la aprobación de Veklury por la FDA, la FDA también emitió una nueva Autorización de uso de emergencia (EUA) para el uso de Veklury en el tratamiento de pacientes pediátricos hospitalizados menores de 12 años que pesen al menos 3,5 kg o pacientes pediátricos hospitalizados que pesen 3,5 kg o menos. de 40 kg con COVID-19 presunto o confirmado por laboratorio para quienes el uso de un agente intravenoso (IV) es clínicamente apropiado. Esta autorización es temporal y puede ser revocada, y no reemplaza el proceso formal de presentación, revisión y aprobación para el uso de Veklury en esta población de pacientes. El uso de Veklury en pacientes pediátricos menores de 12 años o que pesen menos de 40 kilos no ha sido aprobado por la FDA, y no se ha establecido la seguridad y eficacia de Veklury para este uso.