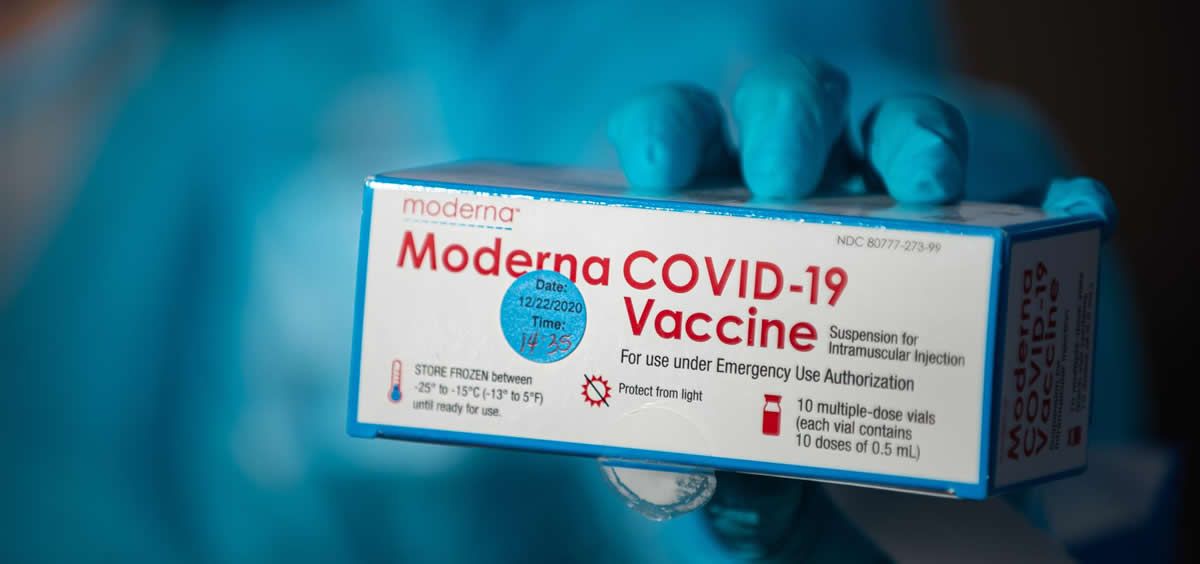
La Agencia Europea del Medicamento (EMA, por sus siglas en inglés) ha dado el visto bueno este miércoles a la vacuna contra el coronavirus de la compañía Moderna, tras una nueva reunión con el comité de medicamentos humanos donde han abordado la vacuna de la farmacéutica estadounidense.
La reunión del lunes finalizó sin una decisión definitiva y ha sido en este nuevo encuentro especial donde finalmente la EMA ha dado su aprobación.
Ahora, tras el informe favorable de la agencia europea sobre la seguridad y eficacia de la vacuna de la norteamericana, se espera que la Comisión Europea lance su propio procedimiento que culmine la autorización 'condicional'.
"Que tengamos esta segunda recomendación de una vacuna positiva en poco menos de un año desde que la OMS declarara la pandemia, es un ejemplo de los esfuerzos y el compromiso adquirido por todos"
Moderna es la segunda farmacéutica que ha solicitado a la EMA estudiar la posibilidad de una Autorización de Comercialización Condicional (CMA, en sus siglas en inglés) para que los países europeos puedan usar su fármaco en las campañas de vacunación que comenzaron la semana pasada, después de que la Comisión autorizara la vacuna creada por Pfizer/BioNTech.
Bruselas ha comprado un total de 160 millones de dosis de la vacuna de Moderna, de la que se necesitan dos inyecciones por persona con un mes de diferencia entre la primera y la segunda aunque, a diferencia de la de Pfizer, Moderna ofrece la ventaja de que no tiene que almacenarse a una temperatura de 70 grados bajo cero, sino a 20 grados bajo cero.
Pfizer y Moderna son las únicas farmacéuticas que han dado hasta ahora el paso de pedir una CMA de uso de su vacuna en la UE, aunque la EMA está estudiando en tiempo real los datos que van compartiendo sobre sus vacunas la empresa AstraZeneca y la Universidad Oxford, por un lado, y Janssen, filial de la norteamericana Johnson & Johnson, por otro, en previsión de que soliciten una CMA en las próximas semanas.
"Esta vacuna nos brinda otra herramienta para superar la emergencia actual. Que tengamos esta segunda recomendación de una vacuna positiva en poco menos de un año desde que la Organización Mundial de la Salud declarara la pandemia, es un ejemplo de los esfuerzos y el compromiso adquirido por todos", ha dicho el director ejecutivo de la EMA, Emer Cooke.
ENSAYO CLÍNICO Y CARACTERÍSTICAS DE LA VACUNA
La decisión se ha basado en los resultados de un ensayo clínico con 30.000 personas de entre 18 y 94 años que no tenían signos de infección previa de Covid-19. En el mismo, se observó una reducción del 94,1 por ciento en el número de casos sintomáticos de Covid-19 en las personas que recibieron la vacuna, en comparación con las personas que recibieron inyecciones simuladas (185 de 14.073 personas).
Asimismo, el ensayo también mostró una eficacia del 90,9 por ciento en participantes con riesgo de Covid-19 grave, incluidos aquellos con enfermedad pulmonar crónica, enfermedad cardiaca, obesidad, enfermedad hepática, diabetes o infección por VIH. La alta eficacia también se mantuvo en todos los géneros, grupos raciales y étnicos.
La vacuna de Moderna se administra en dos inyecciones en el brazo, con 28 días de diferencia
La vacuna de Moderna se administra en dos inyecciones en el brazo, con 28 días de diferencia. Los efectos secundarios más comunes de la vacuna han sido generalmente leves o moderados y mejoraron unos días después de la vacunación. Estos son dolor e hinchazón en el lugar de la inyección, cansancio, escalofríos, fiebre, ganglios linfáticos inflamados o sensibles debajo del brazo, dolor de cabeza, dolor muscular y articular, náuseas y vómitos.
La EMA ha asegurado que la seguridad y eficacia de la vacuna se seguirá controlando a medida que se utilice en toda la Unión Europea (UE), a través del sistema de farmacovigilancia de la UE y estudios adicionales realizados por la empresa y las autoridades europeas.
Hace unas semanas, la agilización del trámite por parte de Bruselas hizo posible que la vacuna de Pfizer y BioNTech se empezara a suministrar en los estados miembros el pasado 27 de diciembre, la misma semana que recibió el visto bueno de la EMA.