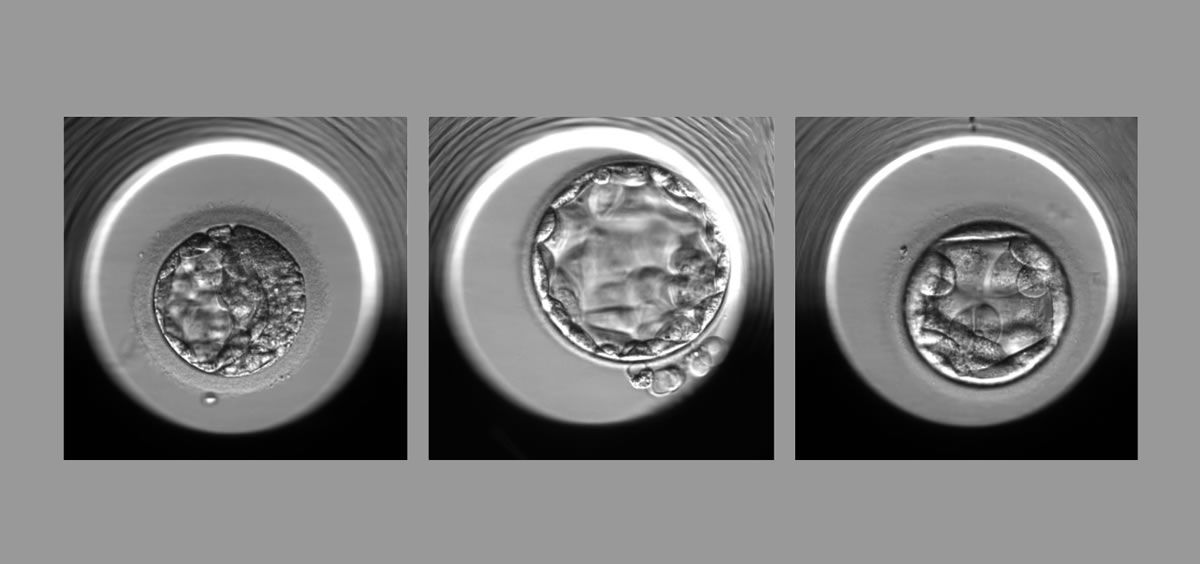
Un algoritmo de inteligencia artificial puede determinar de manera no invasiva, con una precisión de alrededor del 70%, si un embrión fertilizado in vitro tiene una cantidad normal o anormal de cromosomas, según un nuevo estudio impulsado por un equipo de investigadores de Weill Cornell Medicine.
Tener un número anormal de cromosomas, una condición llamada aneuploidía, es una de las principales razones por las que los embriones derivados de la fertilización in vitro (FIV) no se implantan o dan como resultado un embarazo sano. Uno de los métodos actuales para detectar la aneuploidía implica un análisis similar a una biopsia son las pruebas genéticas de las células de un embrión, un enfoque que agrega costes al proceso de FIV y es invasivo para el organismo.
"Nuestra esperanza es que, en última instancia, podamos predecir la aneuploidía de una manera completamente no invasiva, utilizando inteligencia artificial y técnicas de visión por ordenador"
El nuevo algoritmo, STORK-A, descrito en un artículo publicado el 19 de diciembre de 2022 en Lancet Digital Health, puede ayudar a predecir la aneuploidía sin las desventajas de la biopsia. Funciona mediante el análisis de imágenes microscópicas del embrión e incorpora información sobre la edad materna y la puntuación de la clínica de FIV sobre la apariencia del embrión.
"Nuestra esperanza es que, en última instancia, podamos predecir la aneuploidía de una manera completamente no invasiva, utilizando inteligencia artificial y técnicas de visión por ordenador", según ha dicho el autor principal del estudio, el doctor Iman Hajirasouliha, profesor asociado de Genómica Computacional y, de Fisiología y Biofísica en Weill Cornell Medicine, así como miembro del Instituto Englander de Medicina de Precisión.
Según los Centros para el Control y la Prevención de Enfermedades de Estados Unidos se realizaron más de 300 000 ciclos de FIV en el país en 2020, lo que derivó en unos 80.000 nacimientos. Los expertos en FIV siempre están buscando formas de aumentar esta tasa de éxito, para lograr embarazos más exitosos con menos transferencias de embriones, lo que significa desarrollar mejores métodos para identificar embriones viables.

El personal de la clínica de fertilidad usa, en la actualidad, microscopía para evaluar embriones en busca de anomalías a gran escala que se correlacionan con una viabilidad deficiente. Para obtener información sobre los cromosomas, el personal clínico también puede usar un método de biopsia llamado prueba genética preimplantacional para aneuploidía (PGT-A), fundamentalmente en mujeres mayores de 37 años.
Para desarrollar un enfoque computacional para la evaluación de embriones que aprovechó el uso pionero de la fotografía de lapso de tiempo del Laboratorio de Embriología, para lo cuál los investigadores del Centro de Medicina Reproductiva se asociaron con sus compañeros del Instituto Englander.