El impacto de los medicamentos genéricos en el bolsillo de los consumidores es significativo. Según el último informe de la Administración de Alimentos y Medicamentos (FDA), ha ahorrado miles de millones durante la última década. Además, también ha aumentado el acceso a tratamientos vitales para aquellos que de otra manera no podrían permitírselos. Estos fármacos representan más del 80% de todas las recetas dispensadas en los EE.UU., pero sólo representan alrededor del 20% de todos los gastos en medicamentos.
En 2023, el programa de medicamentos genéricos aprobó provisionalmente 956 solicitudes de medicamentos genéricos, conocidas como Solicitudes abreviadas de nuevos medicamentos. “La aprobación de medicamentos genéricos a menudo implica múltiples fabricantes de medicamentos, lo que puede ayudar a estabilizar la cadena de suministro y reducir los riesgos de escasez de medicamentos”, afirma la Dra. Iilun Murphy, directora de la Oficina de Medicamentos Genéricos.
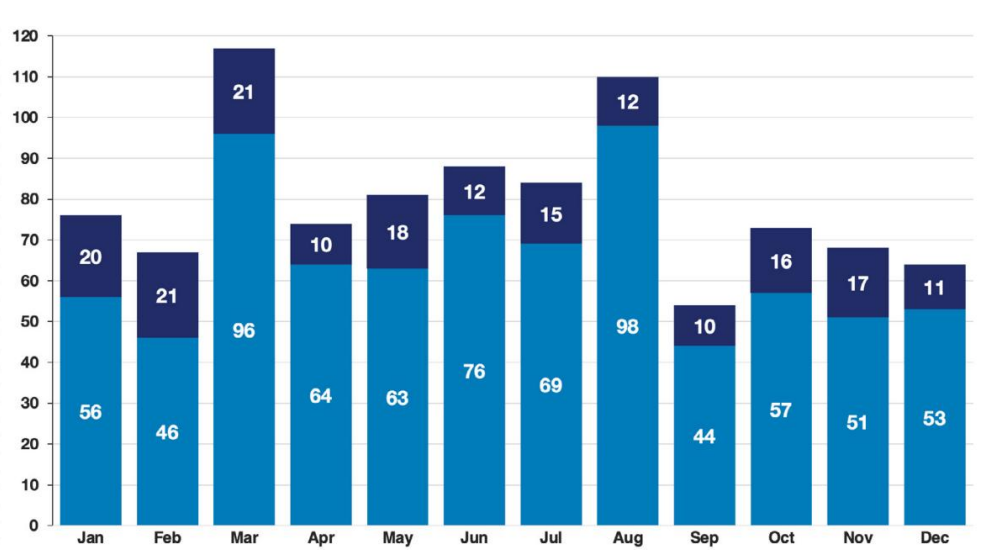
Durante 2023, la Oficina de Medicamentos Genéricos (OGD) dependiente de la FDA, aprobó un total de 90 medicamentos genéricos por primera vez, siendo equivalentes y más asequibles a los medicamentos de marca. Debido a su importancia para la salud pública, la FDA prioriza la revisión de las presentaciones de estos productos. Las aprobaciones del regulador estadounidense permitirán tratar enfermedades como el trastorno por déficit de atención con hiperactividad, el tratamiento de la artritis reumatoide de moderada a grave, la artritis psoriásica, entre otras.
Además, la FDA invirtió aproximadamente 20 millones de dólares (18,4 millones de euros) en proyectos científicos y de investigación. La FDA otorgó fondos para 11 nuevos contratos y 9 nuevas subvenciones, así como 21 contratos en curso y 10 subvenciones en curso. De acuerdo con el compromiso de la FDA de promover ciencia clínicamente relevante y de alta calidad, el personal de OGD y sus colaboradores externos publicaron 70 artículos académicos revisados por pares, presentó 172 charlas externas y 96 carteles en congresos científicos y médicos de todo el mundo.
El año pasado, el programa de medicamentos genéricos inició un proyecto experimental. Este proyecto brinda nuevas oportunidades de encuentro a aquellas empresas del sector farmacéutico que deseen solicitar medicamentos genéricos. Estas oportunidades están dirigidas a aquellos que utilizan el enfoque de Modelo de Evidencia Integrada (MIE) para demostrar bioequivalencia (BE), es decir, que sus medicamentos son tan efectivos como los originales en sus solicitudes de aprobación.
Este proyecto brinda nuevas oportunidades de encuentro a aquellas empresas del sector solicitan medicamentos genéricos
En general, este programa piloto sirve como una plataforma regulatoria especializada para que la industria explore los enfoques MIE propuestos, obtenga el asesoramiento de la FDA sobre su viabilidad y avance y aborde cuestiones científicas y técnicas relevantes. El desarrollo de metodologías innovadoras y herramientas más eficientes son necesarias para establecer estándares de equivalencia de medicamentos, mientras se respalda el desarrollo de medicamentos genéricos, seguros, eficaces y de alta calidad, incluidos los genéricos complejos.
En 2023, la FDA realizó más de 70 proyectos para facilitar a los pacientes el acceso a medicamentos genéricos complejos. Estos proyectos, que se alinearon con ocho áreas prioritarias, forman parte de un esfuerzo llamado Enmiendas de Tarifas de Usuarios de Medicamentos Genéricos (GDUFA). Además, la FDA invirtió recursos para utilizar sus recursos para perfeccionar el desarrollo y la evaluación de estos medicamentos genéricos. Los resultados de esta investigación prepararon a la FDA para evaluar las solicitudes abreviadas de nuevo medicamento de productos complejos, lo que en última instancia aumentó el acceso de los pacientes a genéricos complejos que eran prácticamente imposibles de desarrollar hace unos años.
Otras investigaciones realizadas por la Oficina de Medicamentos Genéricos se centraron en el seguimiento posterior a la aprobación de productos genéricos, la sustitución de productos genéricos y las actitudes entre pacientes, cuidadores y prescriptores relacionados con el rendimiento terapéutico percibido de los productos genéricos.
FORTALECER EL ACCESO SEGURO Y DE CALIDAD
En un esfuerzo por mejorar el acceso de los pacientes a los medicamentos genéricos, la OGD ha tomado medidas para proporcionar una mayor claridad científica y regulatoria a los fabricantes de estos medicamentos sobre cómo pueden cumplir con los requisitos de aprobación. Las recomendaciones de la FDA permiten a estos fabricantes integrar esta información en sus programas de I+D, lo que puede ayudarles a presentar solicitudes de nuevos medicamentos de mejor calidad.
Además, la FDA ha publicado directrices que describen su pensamiento actual y ofrecen recomendaciones a la industria sobre cuestiones relacionadas con los medicamentos genéricos. Se han publicado 12 documentos de políticas para apoyar a los fabricantes de medicamentos genéricos, aclarando las expectativas de la FDA y proporcionando una mayor transparencia en el proceso de evaluación de estos medicamentos.