La enfermedad del hígado graso no alcohólico (NAFLD) es la enfermedad hepática crónica más prevalente en todo el mundo. Se encuentra en el 30% de las personas en los países desarrollados y ocurre en aproximadamente el 25% de las personas en los Estados Unidos. Los factores de riesgo de la enfermedad incluyen obesidad, diabetes, colesterol alto y malos hábitos alimenticios, aunque esto no excluye a las personas sin estos factores de riesgo.
Normalmente se encuentra una pequeña cantidad de grasa en el hígado; sin embargo, si la cantidad de grasa constituye el 5% o más del hígado, esto se considera EHGNA y debe manejarse para evitar una progresión de la enfermedad grave. En el peor de los casos, la EHGNA puede provocar hinchazón e inflamación del hígado, fibrosis o cicatrización del hígado, insuficiencia hepática o cáncer de hígado.
Si la cantidad de grasa constituye el 5% o más del hígado, esto se considera EHGNA y debe manejarse para evitar una progresión de la enfermedad grave
El hígado es un órgano complejo y los eventos fisiológicos involucrados en la progresión de NAFLD involucran múltiples pasos y diferentes tipos de células que se encuentran en el hígado. La acumulación anormal de ácidos grasos en el hígado hace que las células inmunitarias llamadas células de Kupffer, así como las células endoteliales que recubren los vasos sanguíneos del hígado, liberen tanto moléculas de señalización como químicamente reactivas. Estas moléculas estimulan a las células llamadas células estrelladas para sintetizar y depositar proteínas de fibrosis, lo que conduce a la formación de cicatrices en el hígado.
La EHGNA se puede controlar con una dieta saludable y ejercicio y perdiendo y / o controlando el peso, pero actualmente no existe un tratamiento o cura definitiva. Una de las principales dificultades en el desarrollo de tratamientos es que no existen modelos precisos de NAFLD con los que probar la eficacia del tratamiento. Los modelos animales no representan realmente los pasos involucrados en la EHGNA humana y los modelos humanos desarrollados en el pasado también han mostrado limitaciones. Se ha creado un "modelo de fibrosis artificial" relativamente avanzado para estimular la parte final de desarrollo de fibrosis de la secuencia de la enfermedad, pero no se correlacionó completamente con las observaciones de la progresión completa de la enfermedad.
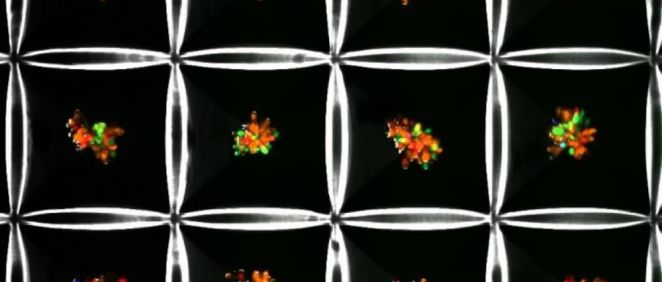
Un equipo colaborativo del Instituto Terasaki para la Innovación Biomédica (TIBI) ha desarrollado un modelo avanzado, multicelular y estructuralmente representativo de hígado en un chip que imita la secuencia de progresión completa de NAFLD. El modelo contiene los cuatro tipos de células primarias humanas que están involucradas en la secuencia: células de Kupffer, células endoteliales, células estrelladas y hepatocitos.
PROCESO DE INVESTIGACIÓN
Las células se mezclaron y se cultivaron como microtissues multicelulares en una serie de micropocillos en forma de pirámide; el número de células y las proporciones se ajustaron para producir microtissues de forma óptima para mantener concentraciones de nutrientes y oxígeno similares a los tejidos hepáticos naturales. A continuación, los microtissues se encerraron dentro de una sustancia gelatinosa para permitir que los tejidos se adaptaran más completamente a la estructura y las interacciones célula a célula de los tejidos hepáticos nativos.
El equipo utilizó su modelo multicelular de hígado en un chip en pruebas diseñadas para validar el papel de las células estrelladas en la EHGNA. Llegaron a la conclusión de que las células estrelladas parecen estar implicadas en la formación de vasos sanguíneos, la producción de compuestos químicamente reactivos y, hasta cierto punto, en la acumulación de ácidos grasos. También concluyeron que las células estrelladas pueden interactuar con Kupffer y otras células del hígado para producir ciertas moléculas de señalización. Todos estos eventos son componentes cruciales en la progresión completa de NAFLD.
El equipo también probó los efectos de la adición de ácidos grasos a su modelo. Los resultados indicaron que la presencia de ácidos grasos y células estrelladas activas aceleró las respuestas inflamatorias y aumentó la producción de proteínas fibróticas, validando aún más el mimetismo del modelo de la progresión natural de NAFLD.
Se espera que se pueda utilizar para dilucidar los mecanismos detrás de esta enfermedad y para probar la eficacia de los posibles tratamientos farmacológicos
Las pruebas posteriores compararon el modelo NAFLD de TIBI con el modelo de fibrosis artificial mencionado anteriormente impulsado por el factor de crecimiento transformante (TGF) -β. Al comparar ambos modelos, el modelo de fibrosis de TIBI imitó la progresión natural de NAFLD al exhibir niveles más altos de acumulación de grasa y moléculas de fibrosis que en el modelo de fibrosis artificial.
Además, el equipo probó la respuesta a los fármacos antifibróticos en ambos modelos. Las pruebas demostraron que el modelo NAFLD de TIBI demostró un transporte de fármacos y una respuesta metabólica más robustos tras la administración de los fármacos. Este hallazgo es significativo si el modelo se va a utilizar para la detección de fármacos potenciales para el tratamiento de NAFLD.
"Nuestro sistema multicelular de hígado en un chip es un modelo de laboratorio que es más avanzado y representa de manera más completa la progresión natural de NAFLD que en modelos anteriores", dijo Junmin Lee, Ph.D., miembro del equipo de TIBI. "Esto está respaldado por los resultados experimentales de nuestros estudios de comparación".
Se espera que el modelo NAFLD de TIBI se pueda utilizar para dilucidar los mecanismos detrás de esta enfermedad y para probar la eficacia de los posibles tratamientos farmacológicos. También tiene el potencial de personalizar tratamientos al obtener la gama completa de células necesarias de pacientes individuales y usarlas para crear modelos personalizados de enfermedades.
"El modelo multicelular descrito aquí es una demostración ejemplar del nivel de trabajo que hacemos en el desarrollo de modelos fisiológicos personalizados", dijo Ali Khademhosseini, Ph.D., director y CEO del Instituto Terasaki. "Tiene el potencial de ayudar a descubrir tratamientos para una enfermedad prevalente y potencialmente fatal".