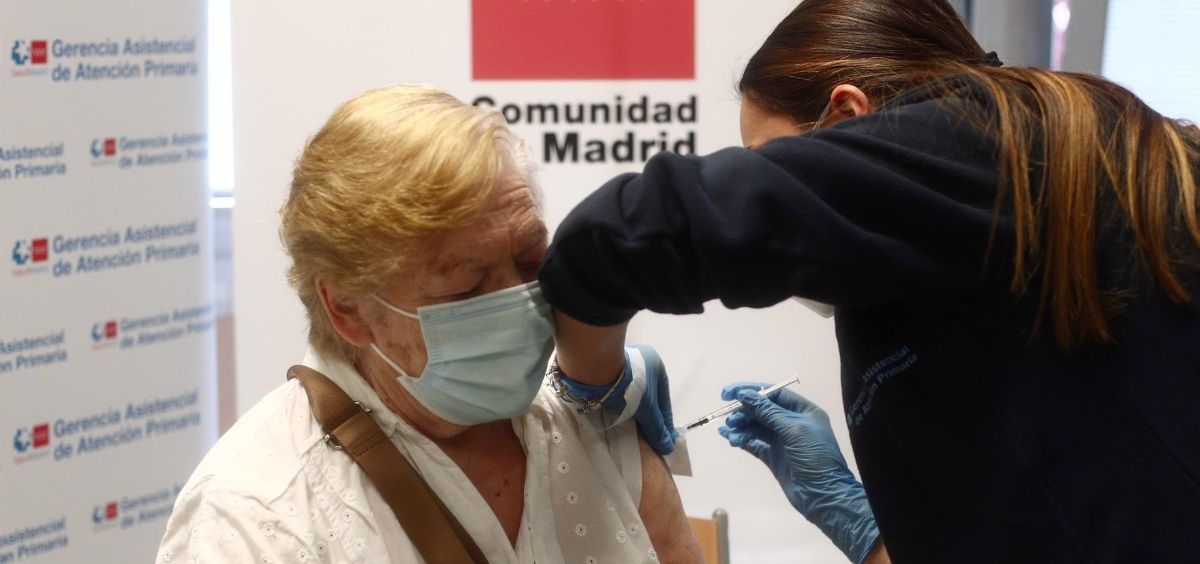
En las últimas horas distintas fuentes relacionadas con el Ministerio de Sanidad han informado de que este lunes 4 de octubre la Agencia Europea del Medicamento (EMA, por sus siglas en inglés), podría pronunciarse para ampliar de forma importante los grupos de personas a los que recomendaría la administración de una tercera dosis de la vacuna contra la Covid-19 desarrollada por Pfizer/BioNTech. Según han informado fuentes cercanas a la agencia la decisión se hará pública a lo largo del 5 de octubre.
Desde el pasado 6 de octubre el Comité de Medicamentos Humanos (CHMP, por sus siglas en inglés) de la EMA se encuentra inmerso en un proceso de evaluación acelerada de la solicitud presentada por la farmacéutica para administrar una tercera dosis en todos los mayores de 65 años, independientemente de su estado de salud. De esta forma seguiría los pasos de otros reguladores como la Administración de Medicamentos y Alimentos de Estados Unidos (FDA, por sus siglas en inglés) que el pasado 23 de septiembre autorizaba la administración de una dosis de refuerzo de la vacuna contra la Covid-19 desarrollada por Pfizer/BioNTech en personas de 65 años y en adelante, y aquellos grupos con alto riesgo de desarrollar enfermedad grave en caso de infección.
“Después de considerar la totalidad de las pruebas científicas disponibles y las deliberaciones de nuestro Comité Asesor de expertos independientes y externos, la FDA modificó la autorización de uso de emergencia de la vacuna contra la Covid-19 de Pfizer/BioNTech para permitir una dosis de refuerzo en determinados grupos de población, como los trabajadores sanitarios, los profesores y el personal de guarderías, trabajadores de tiendas de alimentación y aquellos que se encuentran en refugios para personas sin hogar o que estén en prisión entre otros”, declaraba la comisionada en funciones de la FDA, la doctora Janet Woodcock a través de un comunicado.
Tal y como informan desde El Correo, la posibilidad de que la EMA anuncie de forma inmediata su decisión, mantiene a la Ponencia de Vacunas y a los expertos de la Comisión de Salud Pública, en la que se encuentran representados el Ministerio de Sanidad y las comunidades autónomas, a la espera. Diversas fuentes informan de que el Departamento dirigido por Carolina Darias ya habría iniciado conversaciones con la práctica totalidad de las consejerías de Sanidad autonómicas para pedirlas que, por el momento, mantengan operativos los grandes centros de vacunación que aún no se han desmantelado.
Los grandes centros de vacunación serán necesarios para iniciar una nueva fase de la campaña masiva de vacunación que afectaría a alrededor de nueve millones de españoles
Las referidas fuentes consideran que, en caso de no producirse hoy la conclusión de la EMA, será cuestión de días o, como máximo, de algunas semanas. Motivo por el que los grandes centros de vacunación serán necesarios para iniciar una nueva fase de la campaña masiva de vacunación que afectaría a alrededor de nueve millones de españoles. Por el momento, nuestro país ha administrado ya a alrededor de 350.000 usuarios de residencias de ancianos una dosis de refuerzocomo parte de la pauta de vacunación primaria.
Junto a España, Austria, República Checa, Hungría, Bélgica, Dinamarca, Finlandia, Francia, Alemania, Irlanda, Italia, Polonia, Eslovenia y Suecia, son los países europeos que están administrando algún tipo de refuerzo a algunos grupos poblacionales sin que la EMA se haya pronunciado al respecto. En caso de que la agencia reguladora finalmente se pronuncie hoy de forma positiva se dotaría a los referidos países de un mayor amparo legal.
Y es que hace algunas semanas la Comisión Europea advertía de “los riesgos legales” que supone administrar dosis de refuerzo sin que la EMA haya respaldado este movimiento. Unas decisiones nacionales sobre las que la Comisión Europea recalcaba que “no forman parte de la autorización de comercialización de las vacunas Covid-19”.
Además, tal y como informaban hace unos días desde Reuters, es posible que el pronunciamiento de la EMA no precise de forma exacta los grupos poblacionales a los que se destinan estas terceras dosis. Su juicio, más bien, podría tratarse de aspectos relacionados con la seguridad y la eficacia de estos siguiendo así la estela de decisiones anteriores dejando libertad a cada país para decidir si inocula o no los refuerzos.
Por el momento, salvo que se trate de personas con sistemas inmunitarios comprometidos o cuyo estado de salud y/o edad avanza así lo requiera, tanto la EMA como el Centro Europeo para la Prevención y el Control de Enfermedades (ECDC, por sus siglas en inglés), como la Organización Mundial de la Salud (OMS), consideran innecesarias la administración de dosis de refuerzo en la población general, especialmente cuando muchos países de bajos ingresos aún no han podido inmunizar a porcentajes significativos de su población.